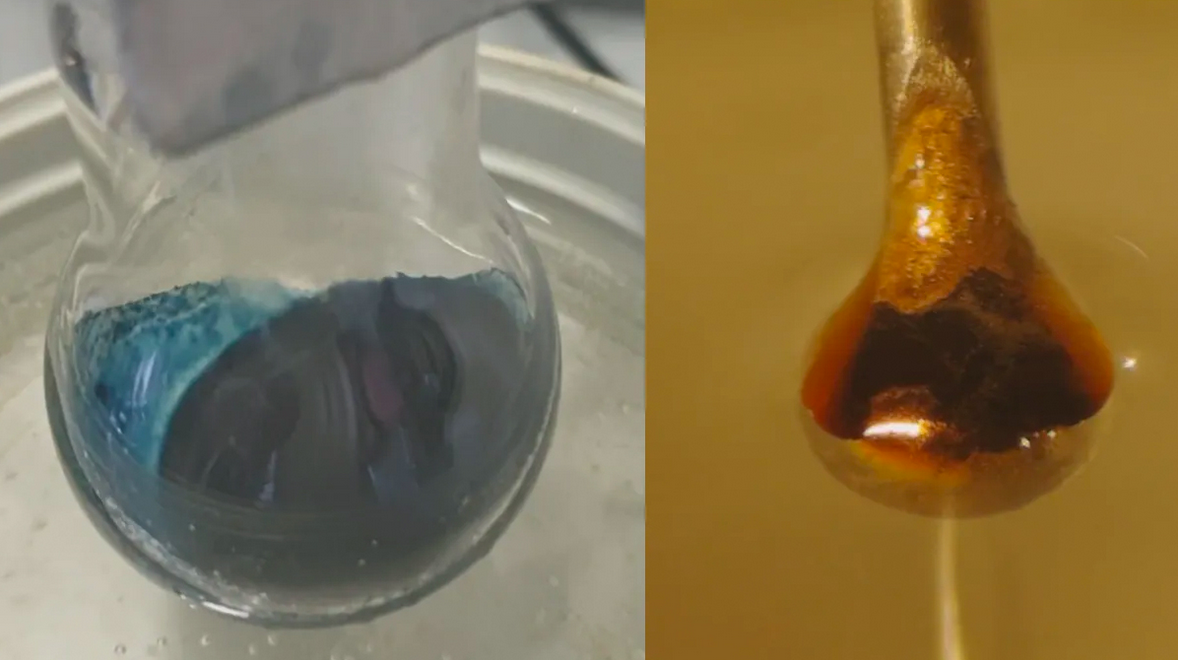قد يستطيع العلماء أخيرًا فهم تحول غريب حصل في تجربة كيميائية حصلت قبل قرن من الزمان. تُحوّل إضافة إلكترونات إلى محلول أمونيا أزرق لامع المحلولَ إلى معدن برونزي ساطع، وهذا ما حير العلماء مدة طويلة.
تكشف الدراسة الجديدة التفاصيل الدقيقة لهذا التغيير، وتُظهر أن هذا التحول يحصل تدريجيًا لا لحظيًا.
يقول مُجري الدراسة ريان ماكمولين، طالب دكتوراه في الكيمياء في جامعة جنوب كاليفورنيا: «ما حققناه بنجاح هو فهم سلوك هذه المحاليل في نطاق واسع من التركيزات، باستخدام تقنية النفاثات الدقيقة». هذه التقنية التي تتضمن إطلاق تيارات من المحلول بسُمك الشعرة في الفراغ، لم تُستخدم على السائل اللامع من قبل.
وقال ماكمولين إن هذا الاكتشاف قد يكشف عن تفاعلات جديدة في علم الكيمياء العضوية.
ما هي المعادن؟
المعادن مجموعات متنوعة. بعضها خفيف بما يكفي ليطفو على سطح الماء، مثل مادة الليثيوم، وبعضها الآخر كثيف جدًا مثل الرصاص والأوزميوم. بعضها يحتاج إلى درجة حرارة عالية لينصهر، وبعضها الآخر ينصهر بسهولة، فمثلًا، يذوب الزئبق عند درجة حرارة سالب 38.3 مئوية. في النهاية، الأمر المشترك بين جميع المعادن هو قدرتها على توصيل الكهرباء عند الصفر المطلق، الدرجة التي تتوقف عندها حركة الجزيئات الناتجة عن الحرارة.
كيف تتحول بعض غير المعادن إلى معادن؟
في دراسة جديدة، أجاب الباحثون عن هذا السؤال بإضافة معادن إلى أمونيا سائلة.
في البداية، كاثف الباحثون الأمونيا -التي تكون غازيةً عند درجة حرارة الغرفة- إلى الحالة السائلة بتبريدها لدرجة سالب 33 مئوية. ثم أضافوا إليها الصوديوم أو الليثيوم أو البوتاسيوم، وهي جميعها معادن قلوية مشهورة بتفاعلها المتفجر عند غمسها بالماء. أجريت هذه التجارب بالتعاون مع علماء من الأكاديمية التشيكية للعلوم ومعهد فريتز هابر التابع لجمعية ماكس بلانك في برلين، وأيضًا مع باحثين من اليابان وفرنسا.
كانت النتيجة متوقعة: سحبت الأمونيا السائلة الإلكترونات من المعدن. أصبحت بعد ذلك هذه الإلكترونات محاصرة بين جزيئات الأمونيا، مكونة بذلك إلكترونات مذابة كان يأمل الباحثون دراستها. عند تركيزات منخفضة، كانت النتيجة سائلًا أزرق غير معدني. ولكن، كلما تكدست الإلكترونات المذابة، تحول المحلول لبرونز لامع.
كان التحدي التالي بحث تصرف الإلكترونات الذائبة في تركيزات مختلفة. تضمن هذا البحث إطلاق نفاثات دقيقة من المحلول -بسمك شعرة الإنسان تقريبًا- خلال أشعة سينية سينكروترونية، وهي أشعة سينية عالية الطاقة. حفزت الأشعة السينية الإلكترونات المذابة، ما أدى إلى خروجها من قفصها السائل داخل جزيئات الأمونيا. استطاع العلماء حينها قياس مقدار الطاقة المطلوبة لتحرير الإلكترونات المذابة.
وجد الباحثون أنه مع زيادة تركيز الإلكترونات المذابة، يزيد التشابه في إطلاق الطاقة بين المحلول والمعدن. وما يعنيه ذلك: إذا رسمت رسمًا بيانيًا لمقدار الطاقة المطلوبة لتحرير الإلكترونات من قفصها داخل محلول الأمونيا، نجد أن للمعادن خاصية تُعرف بحد فيرمي، وهو تحول لحظي، كما قال ماكمولين. في تركيزات منخفضة من الإلكترونات المذابة، يبدو الرسم البياني هذا مثل تلة مستديرة. فقط عند تركيزات عالية نشهد حدوث خاصية حد فيرمي. وأضاف ماكمولين أن هذا الحد يعكس مقدار الطاقة التي تمتلكها الإلكترونات عند درجة حرارة معينة.
وأضاف ماكمولين قائلًا: «عندما تزيد التركيز للمجموعة المعدنية فإنك ترى نشوء هذا النمط الرائع القريب جدًا من خصائص المعادن».
وكانت النتائج مثيرة للاهتمام إذ أظهرت أن السائل الشبيه بالمعدن المتكون من إضافة معادن قلوية للأمونيا، هو في الحقيقة معدن على المستوى الجوهري الفيزيائي.
«إنه معدن حقيقي، وليس شيئًا يشبه المعادن».
تُستخدم الإلكترونات المذابة منخفضة التركيز في نوع من التفاعلات يدعى تفاعل بيرش، الذي يضيف إلكترونات إلى تركيبات جزيئية تسمى الحلقات العطرية.
استُخدم هذا النوع من التفاعل في تصنيع أول حبوب منع حمل فموية في الخمسينات من القرن الماضي. وبفهم كيفية عمل الإلكترونات المذابة عند تركيزات عالية، قد يكون الباحثون قادرين على إيجاد أنواع جديدة من التفاعلات الكيميائية. مثلًا، يمكنهم تحفيز الإلكترونات المذابة باستخدام أشعة ضوئية لجعلها تتصرف بطرائق جديدة.
وقال ماكمولين أيضًا: «إذا دغدغت الإلكترونات قليلًا لتصبح أكثر طاقة وحيوية، تمكنك مشاهدة بعض التفاعلات الجنونية التي لا تحصل بأي طريقة أخرى».
أعلن الباحثون عن نتائجهم في الخامس من حزيران/ يونيو في مجلة العلوم.
اقرأ أيضًا:
ماذا نعني ﺑ «الهيدروجين المعدني»؟
ترجمة: سامي أنضوني
تدقيق: عون حدّاد