تنشأ الحالة الديناميكية للبروتينات بتحليل مصير الأحماض الأمينية الثابتة الموسومة بالنظائر، التي سبق وأطعمت للفئران. سبقت هذه التجارب التقليدية التي أجراها رودولف شوينهايمر في أواخر الثلاثينيات من القرن الماضي، تقنيات وسم النظائر المستقرة الحديثة (مثل SILAC)، التي تسمح بتحديد معدل دوران مئات إلى آلاف من البروتينات كل على حدة، بتحليل مطياف الكتلة الواحدة.
بعد هذا الاكتشاف، اعتُبر الحيز الليزوزومي الموقع الرئيسي لتدهور البروتينات الخلوية، من خلال عمل البروتياز المعتمد على الحموضة. إلا أن هذا الرأي قد تراجع مع ظهور الدليل القاطع بأن نصف عمر معظم البروتينات الخلوية لا يتأثر بقلونة الجسيمات الحالة.
إن الاكتشاف المتقدم لنظام تحلل البروتين عبر اليوبيكويتين والبروتيازات، ومعرفة أنه المسار الرئيسي لتدهور البروتينات، أدى إلى تشكل رأي جديد. مبدأ هذا النموذج الجديد هو الفكرة القائلة بأن تعديل البروتينات المستهدفة بربطها تساهميًا مع ببتيد مكون من عدة جزيئات من اليوبيكويتين، يوجهها نحو معقد التحلل البروتيني الكبير (26S) المعروف باسم البروتيوزوم.
كان من المفاجئ اكتشاف أن إضافة اليوبيكويتين تشكل إشارةً لتوجيه المستقبلات المُلتَقَمة إلى مسار التحلل الليزوزومي. وحديثًا اكتشف أنها تضاف كذلك لتمييز العضيّات الخلوية للتخلص منها عبر طريق مسار التحلل الخلوي الثالث الرئيسي للبلعمة الذاتية. ويبدو أن دور بروتين اليوبيكويتين في تدرك البروتينات منتشر أكثر مما كنا نعتقد.
اليوبيكويتين هو بروتين صغير موجود تقريبًا في كل الأنسجة الخلوية لدى الإنسان والكائنات حقيقية النوى، وهو يساعد على تنظيم عمل البروتينات الأخرى في الجسم.
يمكن ربط جزيئة يوبيكويتين إلى بروتين ما بعملية تسمى إضافة اليوبيكويتين (الوبكنة)، التي تعدل وظيفة البروتين، هذا يؤدي إلى عدة نتائج مختلفة.
وعلى الرغم من أن جزيئة بروتين اليوبيكويتين تؤدي دورًا كبيرًا في عدة عمليات خلوية متعلقة بتنظيم البروتينات، فإنها تعد مشهورةً لدورها في تدرّك البروتينات وتحللها.
بروتين اليوبيكويتين تاريخيًا:
اكتشف لأول مرة عام 1975 على يد مجموعة من الباحثين بقيادة الباحث غولدستين. تلا ذلك بفترة قصيرة إجراء بحث تابع لتوصيف جزيئة البروتين هذه، والعمليات الحيوية المتعلقة بها. وقد نشأت نظرية الوبكنة خلال ذلك، وأثارت الاهتمام حول احتمالية استهداف خلايا معينة لتتدرك على يد البروتيوزومات.
في بحث حديث لهم، عزز آرون سيكانوفر وآفرام هيرشكو وإيروين روز فهمنا بشأن وظيفة بروتين اليوبيكويتين. إذ أظهر بحثهم إمكانية التحكم بدورة حياة الخلية لتغيير عمليات بيولوجية محددة، مثل انتساخ الجينات والوظيفة المناعية. كان لاكتشافهم هذا الفضل في فوزهم بجائزة نوبل في الكيمياء لعام 2004.
عملية إضافة اليوبيكويتين:
تحدث عملية إضافة اليوبيكويتين عند ارتباط جزيء يوبيكويتين مع بروتين؛ هذه العملية تعد نوعًا من تعديلات ما بعد الترجمة.
تتكون هذه العملية من ثلاث خطوات، تؤديها مجموعة محددة من الإنزيمات؛ الخطوات على التتالي:
- التنشيط: وتقوم به إنزيمات منشّطة لِـ اليوبيكويتين E1s.
- الاقتران: وتقوم به إنزيمات تقرن اليوبيكويتين E2s.
- الربط: وتقوم به إنزيمات رابطة لليوبيكويتين (يوبيكويتين ليغاز) E3s.
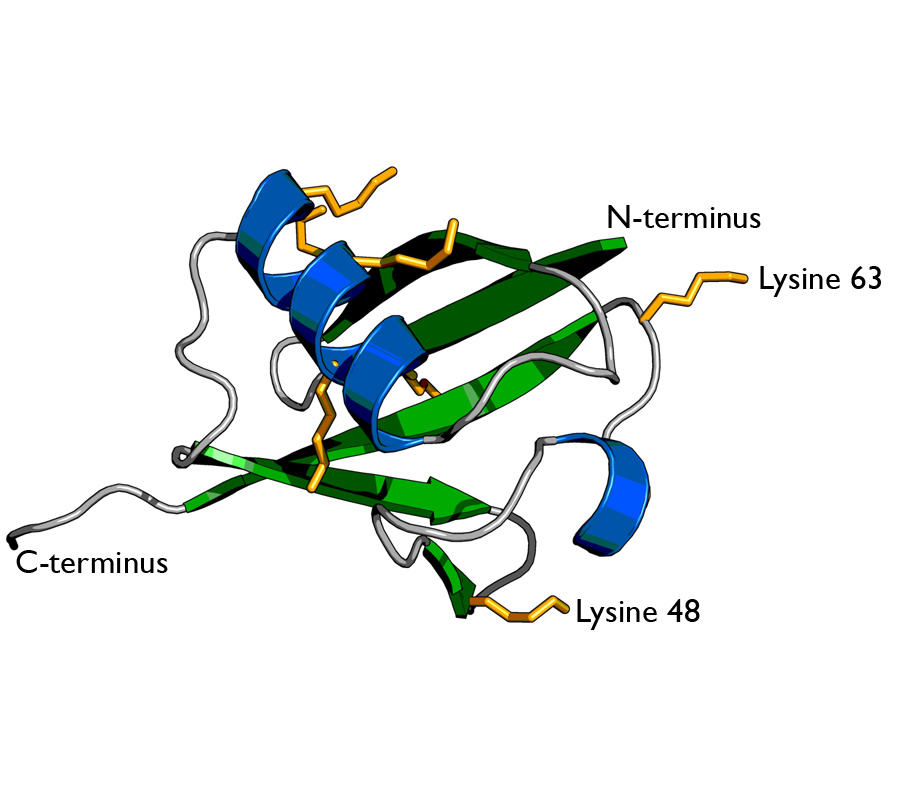
يشكل جزيء اليوبيكويتين عبر هذه الخطوات رابطةً إيزوببتيدية بارتباطها مع ثمالة الليزين على البروتين الهدف. وقد تحدث الوبكنة أحيانًا عبر ربطه برابطة ببتيدية مع النهاية الأمينية للبروتين الهدف.
قد يضاف جزيء واحد من بروتين اليوبيكويتين فقط، ونسمي هذه العملية عندئذ بـِ الوبكنة المفردة monoubiquitination. وقد تضاف عدة جزيئات من بروتين اليوبيكويتين مشكلةً سلسلةً، وحينها نسمي العملية بـِ الوبكنة المتعددة polyubiquitination.
وظيفة اليوبيكويتين:
تتنوع تأثيرات الوبكنة بشكل كبير. كما ذكرنا سابقًا، إذ يعد تدرّك البروتينات المستهدفة عبر البروتيوزومات أكثر النتائج شيوعًا. ومع ذلك قد تؤثر إضافة بروتين اليوبيكويتين على فعالية أو موقع أو حتى تفاعل البروتين المستهدف مع البروتينات الأخرى.
تشمل تأثيرات إضافة اليوبيكويتين:
- الموتَ الخلوي المبرمج.
- الانقسام الخلوي.
- التضاعف.
- تدرّك الخلايا العضلية والعصبية.
- انتساخ وإصلاح الدنا «DNA»
- الاستجابة المناعية والالتهابية.
- تشكيل الشبكة العصبية.
- التشكل الحيوي للعضيات الخلوية.
- معالجة المستضدات.
- تعديل المستقبلات.
- تشكيل الريبوزومات ومسار الاستجابة للتوتر.
- العدوى الفيروسية.
المعدلات الشبيهة باليوبيكويتين:
توجد عائلة كاملة من البروتينات تتفاعل مع البروتينات الأخرى بطريقة مشابهة لليوبيكويتين، تدعى بالمعدلات الشبيهة باليوبيكويتين.
يختلف أعضاء هذه العائلة عن بعضهم بعضًا بوضوح، لكنهم جميعًا يمتلكون بنيةً ثلاثية الأبعاد، متطويةً الشكل، ونهايتها الكربوكسيلية تحوي الحمض الأميني الغليسين، تلك التي نُميز بها هذه العائلة.
تؤدي المعدلات الشبيهة باليوبيكويتين إلى نتائج مشابهة لعمل اليوبيكويتين، لكنها قد تختلف في بعض الحالات، على سبيل المثال يمكن لأحد المعدلات المسمى SUMO الارتباط مع بروتين مرتبط مسبقًا مع اليوبيكويتين (إشارةً للبروتيوزومات لتدرّك هذا البروتين)، فيزيد هذا الارتباط من ثباتية هذا البروتين، ويحميه من التدرّك.
اقرأ أيضًا:
البروتين بي 53: بنيته ووظيفته وآلية عمله
الليزوزوم أو الجسيم الحال أو اليحلول
ترجمة: تيماء الخطيب
تدقيق: منال توفيق الضللي