يستخدم أحيانًا الكيميائيون رسمًا تخطيطيًا لمستويات الطاقة لتمثيل الإلكترونات عند دراستهم للتفاعلات والروابط الكيميائية. والذي يُعد أكثر فائدةً وأسهل في استخدامه من الأرقام الكمومية في النموذج الميكانيكي الكمومي. يُستخدم مخطط مستويات الطاقة مع نظام التوزيع الإلكتروني لتمثيل مستوى الطاقة ، و(مستوى الطاقة الفرعي – subshell) ، والمدار الذي تشغله الإلكترونات في أي ذرة. تُستخدم هذه المعلومات في الأغراض التالية:
- للتنبؤ بنوع الرابط الذي سيحدث مع عنصر معين، ومعرفة الإلكترونات التي ستُستخدَم بالضبط.
- لمعرفة السبب وراء تصرف بعض العناصر بطرق متماثلة.
تمثيل الإلكترونات بواسطة مخطط مستويات الطاقة
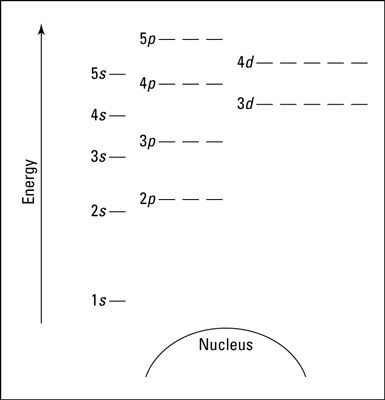
الرسم البياني التالي هو مخطط فارغ لمستويات الطاقة يمكن استخدامه لتمثيل إلكترونات أي ذرة. لا يحتوي المخطط جميع المدارات المعروفة والمستويات الفرعية. لكن يمكن استخدامه للقيام بكل ما تحتاجه.
*تذكر: في المخطط السابق، يُمثل المدار بشرطة. وبإمكان المدار الواحد استيعاب إلكترونين كحد أقصى. المدار الأول هو الأقرب إلى النواة ويمتلك أدنى طاقة، وهو المدار الوحيد في مستوى الطاقة الأول.
يحتوي مستوى الطاقة الثاني على مداري s وp، يمتلك 2p طاقةً أكبر من 2s لذا يحتوي على ثلاث مستويات فرعية تُمثَل بثلاث شرطات متساوية الطاقة.
نرى أيضًا مستويات الطاقة الثالث والرابع والخامس. من غير المتوقع أن يمتلك المدار 4s طاقةً أقل من المدار 3d، قد يبدو ذلك غريبًا، ولكن هذا ما لوحظ في الطبيعة.
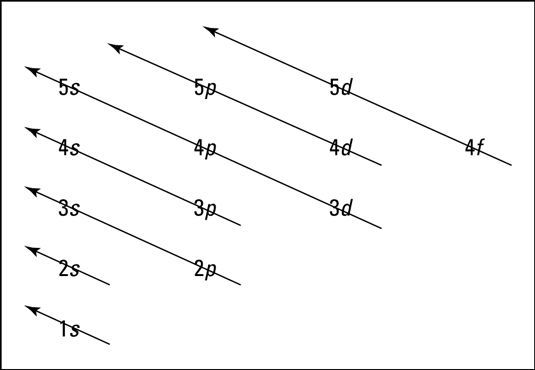
يُظهر الرسم التوضيحي التالي مبدأ (أوف باو – Aufbau)، وهو طريقة لتذكر الترتيب الذي تملأ به المدارات مستويات الطاقة الشاغرة.
عند استخدام مخطط مستويات الطاقة، تذكر شيئين:
- تملأ الإلكترونات مستويات الطاقة الشاغرة الأدنى أولًا.
- عندما وجود أكثر من مستوى فرعي في مستوى طاقة معين، كمثال على ذلك المستويان 3p و4d، فإن إلكترونًا واحدًا فقط يملأ كل مستوى فرعي، حتى يمتلك كل منها إلكترون واحد. ثم تبدأ الإلكترونات في الاقتران. وتسمى هذه القاعدة بـِ(قاعدة هوند – Hund’s rule).
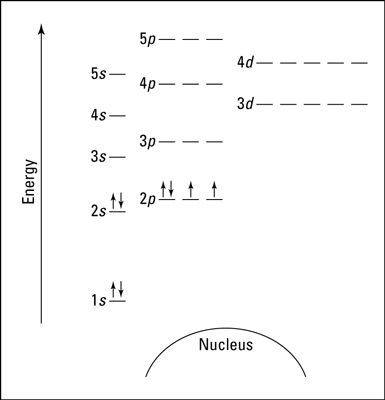
لنفترض الآن أنك تريد رسم مخطط مستويات الطاقة للأكسجين، ثم نظرت إلى الجدول الدوري ووجدت أن الرقم الذري للأكسجين هو 8، أي أن الأكسجين يمتلك 8 بروتونات في نواته، و 8 إلكترونات. لذلك تضع 8 إلكترونات على مخطط مستويات الطاقة.
*ملاحظة: يمكن تمثيل الإلكترونات بسهام. إذا انتهى المطاف بإلكترونين في نفس المدار، يمثل أحدهما بسهم يتجه للأعلى والآخر بسهم يتجه للأسفل. يملأ الإلكترون الأول أدنى مستوى للطاقة، المدار 1s أولًا، ويقترن الإلكترون الثاني مع الأول.
يملأ الإلكترونان الثالث والرابع مدار الطاقة الأدنى التالي 2s.
يملأ الإلكترون الخامس أحد المدارات الفرعية للمدار 2p (لا يهم أي واحد فيها إذ تمتلك جميعها نفس الطاقة)، ويملأ الإلكترونان السادس والسابع المدارين الفرعيين الآخرين الخاليين للمدار 2p.
يقترن الإلكترون الأخير مع أحد الإلكترونات الموجودة في المدار 2p.
بعد تطبيق هذه الخطوات ستحصل على مخطط مستويات الطاقة لعنصر الأكسجين كالتالي:
اقرأ أيضًا:
العلماء يسرعون الإلكترونات في موجة بلازما.. فهل نودع مصادم الهادرونات الكبير؟
كون الإلكترون الواحد. هل إلكترونات الكون عبارة عن إلكترون واحد؟
ترجمة: رتاج إبراهيم
تدقيق: حسام التهامي