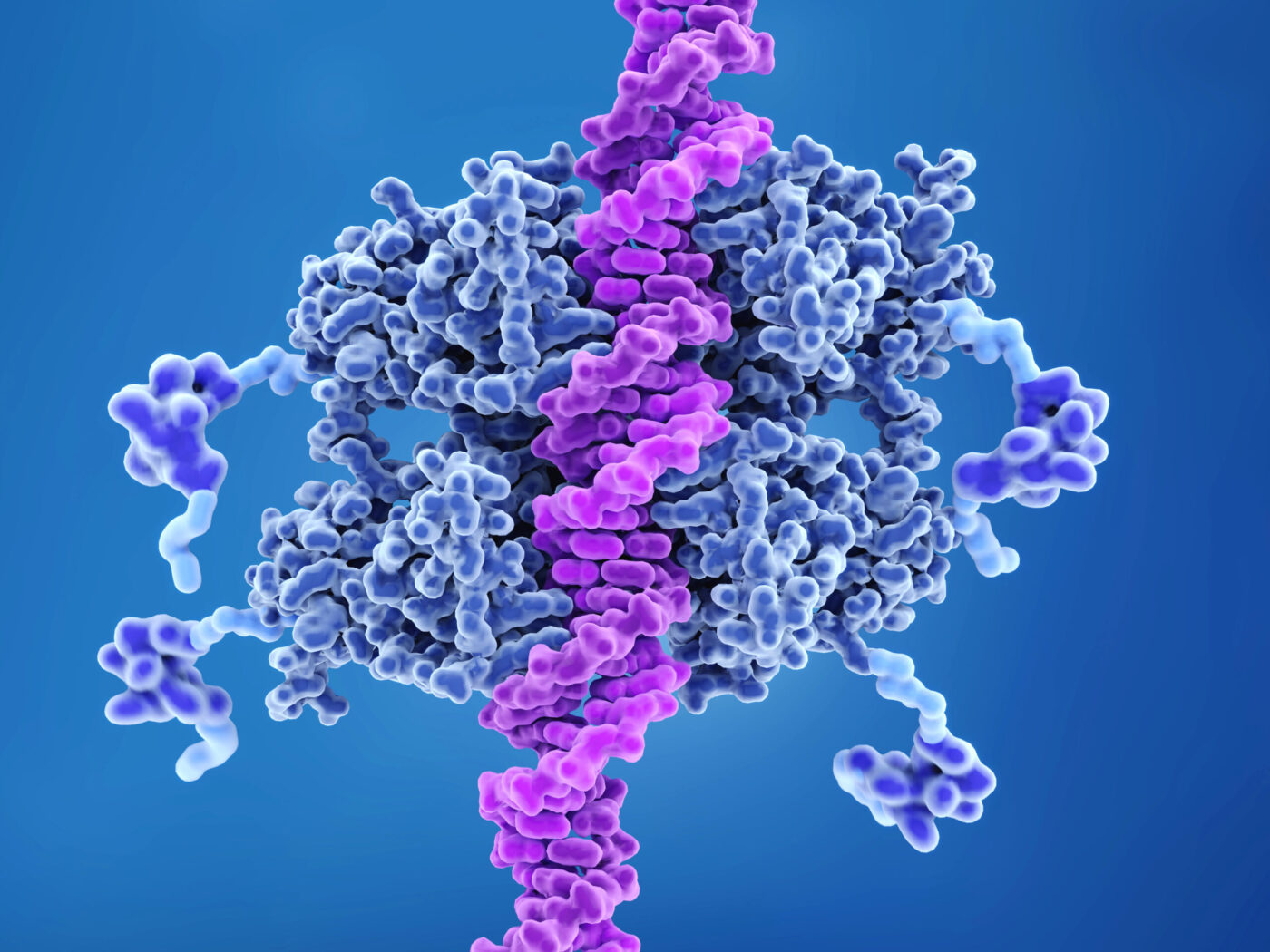
من المستحيل تحوّل أي خلية طبيعية إلى خلية سرطانية ما لم تُعَطل شبكة البروتين بي 53 (p53). جاء الفهم الحالي لشبكة البروتين هذه من الأبحاث المتنوعة حول البروتين بي 53، إذ ظهرت كثير من النتائج صدفةً وتحولت مع مرور الوقت إلى نتائج واضحة. تقدم هذه المقالة رؤى حول طبيعة السرطان والتقدم العلمي في هذا الموضوع.
كيف اكتُشف البروتين بي 53؟
في عام 1979 أبلغت ست مجموعات من العلماء المستقلة عن بعضها عن وجود البروتين بي 53 كيلو دالتون ضمن خلايا الإنسان والفئران، خمس من هذه المجموعات اكتشفته لارتباطه بالمستضد T الكبير في الخلايا المصابة SV40 وترسبه مناعيًا مع الأجسام المضادة المتولدة ضد البروتينات الفيروسية.
واكتشف نفس البروتين صدفةً عندما ولّد مصل مضاد كيميائيًا ضد الورم اللحمي الفأري، إذ تفاعل مع البروتين بي 53 كيلو دالتون الموجود في خلايا الفئران الطافرة وغير الطبيعية.
لماذا كان يعتقد أن البروتين بي 53 هو جين سرطاني؟
استمرت الدراسات حول هذا البروتين وشملت ترميز الجينات المتعلقة به، وأشارت مجموعة متنوعة منها إلى أن البروتين بي 53 كان يُعد جينًا سرطانيًا، ويعود هذا الاستنتاج إلى طبيعة الأبحاث في منتصف الثمانينيات والأدلة التجريبية المُقنعة، إذ كان يُعتقد أن الجينات الورمية هي المفتاح لفهم مرض السرطان، واكتُشفت ضمن الحمض النووي الريبي والحمض النووي للفيروسات السرطانية، بينما كان وجود جينات مثبطة للورم أمرًا فرضيًا تمامًا، وبالكاد يتمكن باحثو الأمراض السرطانية من كشفه.
كان البروتين بي 53 مرتبطًا بالبروتين الورمي الرئيسي لـ SV40، ما يشير بقوة إلى تأثيره في المراحل النهائية على مسار المستضدات الكبيرة T، وكان هذا التفسير متوافقًا مع المستويات العالية المُعبرة عن البروتين بي 53 والموجودة في كثير من أنواع السرطان. وكانت الميزة الأساسية للاكتشاف أنه يشير إلى أن إدخال جين البروتين بي 53 إلى خلية طبيعية قد يحولها إلى خلية ورمية. ومع أن قليلًا من التجارب لم تدعم هذه الفكرة فلم يوجد سبب وجيه للاعتقاد بخلاف ذلك في منتصف الثمانينيات.
كيف يُعرف أن البروتين بي 53 هو جين مثبط للورم؟
حدثت نقطة التحول في الأبحاث حول البروتين بي 53 عام 1989، وكان تغييرًا جذريًا جاء من جهة لا صلة لها بالبحث ظاهريًا، كما يحدث غالبًا في معظم الأبحاث، ففي أثناء البحث عن الجين الذي من المفترض أنه المثبط للورم الموجود على الكروموسوم بي 17 انتقل التركيز إلى منطقة صغيرة تحتوي على البروتين بي 53، ولاستبعاد كون البروتين بي 53 جينًا مُثبطًا للورم تمامًا استُخدم اختبار الضربتين.
تعمل الجينات المثبطة للورم كمكابح السيارات فهي توقف نمو الورم، ولكن نظرًا الى أن الخلايا تحتوي على نسختين من الكوابح (واحدة من الأب والأخرى من الأم)، فمن الضروري تغيّر النسختين للتخلص من المكابح. وبالمقارنة، تعمل الجينات الورمية الطافرة كالمسرعات التي يجب أن يعلق واحدٌ منها فقط لجعل السيارة تواصل السير.
يسمح اختبار الضربتين بالتمييز إن كان الجين المتحول جينًا ورميًا أم جينًا مثبطًا للورم، فإذا تغيرت النسختان من الجين من المحتمل أن يكون الجين مثبطًا للورم، أما إذا تغيرت نسخة واحدة فقط فمن المرجح أن يكون الجين ورميًا.
كانت نتائج هذا الاختبار على البروتين بي 53 غير متوقعة. فأولًا، معظم أورام القولون وأورام المستقيم تبيّن بما يثير الدهشة أن لديها طفرات طفيفة من البروتين بي 53، وذلك عمومًا باستبدال أساس واحد (مثل C إلى T) ما أدى إلى تشكيل حمض أميني جديد، ولم تُلاحظ مثل هذه الطفرات ضمن البروتين بي 53 من قبل. ثانيًا، في الغالبية الساحقة من الحالات حدثت الطفرة على نسختي البروتين بي 53، فالأولى تغيرت بالاستبدال الأساسي وغالبًا ما حُذفت النسخة الثانية من الخلية. كانت هذه النتيجة متوقعة للجين المثبط للورم لا الجين الورمي.
أُجري اختبار الضربتين على عدة أنواع من الأورام الأخرى، وعُثر على نتيجة مماثلة، لم تتعلق نتيجة الأبحاث بإرسال البروتين بي 53 إلى مركز الخلايا الورمية لدى البشر فحسب، بل قدمت أيضًا دليلًا مقنعًا على أن البروتين بي 53 كان في الواقع جينًا مثبطًا للورم. أُكّد هذا الاستنتاج بالنتائج اللاحقة، فالمرضى الذين يعانون من طفرات وراثية في البروتين بي 53 كانوا أكثر عرضة للإصابة بأنواع متنوعة من الأورام، والفئران التي تحمل جينًا مُعطلًا من البروتين بي 53 كانت أيضًا عرضة للإصابة بالأورام.
أظهرت الدراسات اللاحقة أن البروتين بي 53 يتكرر تحوره ضمن الأورام البشرية أكثر من أي جين آخر في الجينوم، وأبلغ عن أكثر من 25000 طفرة حتى الآن.
ما تأثير البروتين بي 53 في نمو الخلايا؟
يثبط البروتين بي 53 تشكيل الأورام باستخدام آليات فهمناها بدراسة الخلايا المزروعة على أوساط مغذية، وبعد إزالة الاشتباه الأولي حول التسلسل الفعلي للنوع الوحشي لجين البروتين بي 53 (wt p53)، أصبح من الواضح أن لجين البروتين بي 53 الوحشي دور في تأخير نمو الخلايا المزروعة عندما يزداد التعبير عنه، ولكن ليس لطفرات هذا الجين. قد ينتج التأخر في نمو الخلايا عن الانخفاض في معدلات تشكيل خلايا جديدة أو عن تثبيط موت الخلايا.
وفقًا لدراسة كلاسيكية عام 1991، أدى التعبير عن البروتين بي 53 الوحشي في خلايا سرطان الدم إلى القضاء عليها بالاستماتة (موت الخلايا المبرمج).
أثبتت هذه الدراسة السبب الرئيسي لتزايد الموت المبرمج للخلايا وأظهرت أن لتنظيم موت الخلايا المبرمج أهمية تنظيم تشكيل خلايا جديدة في العمل الجيني لتثبيط الورم. من الواضح الآن أن البروتين بي 53 الوحشي يسيطر على الخلايا بالطريقتين وهما موت الخلايا وتنظيم تشكيل الخلايا الجديدة عبر تثبيط دورة الخلية وتعزيز موت الخلايا المبرمج.
كيف يعمل البروتين بي 53 على المستوى الكيميائي الحيوي؟
في بداية التسعينيات ظهرت ملاحظتان أساسيتان: للبروتين بي 53 مجال تنشيط، ويستطيع الارتباط بسلاسل محددة للحمض النووي، وسرعان ما ثبت أن البروتين بي 53 الوحشي بطوله الكامل يعمل منشطَ نسخ لتسلسلات خاصة ضمن الأجسام الحية وفي المخابر، ومن المهم أيضًا ملاحظة خسارة الطفرات المشتقة من الورم لكل وظائفها المهمة تقريبًا. وقد كشف اشتقاق أول موقع ترابط عام في البروتين 53 عن تسلسل كبير ومرن على غير المعتاد، مع النيوكليوتيدات الثابتة الرئيسية.
البنية البلورية للبروتين بي 53 الأساسي المرتبط بالحمض النووي تظهر بدقة أية ثمالات منه نتجت عن اتصاله بالحمض النووي، وكشفت أيضًا الطريقة التي تلغي بها الطفرات هذا الارتباط. حددت الدراسات اللاحقة عدة جينات مُنشطة نسخيًا بواسطة البروتين بي 53 بمواقع الرابطة التي تستهدف المواقع التنظيمية الخلايا. وشملت CDKN128 مثبطات دورة الخلية، والبروتينات المحفزة للموت الخلوي المبرمج PUMA، و NOXA المسؤول جزئيًا عن سيطرة البروتين بي 53 على نمو الخلايا.
ما الذي ينظم عمل البروتين بي 53؟
منذ الأيام الأولى للبحث حول البروتين بي 53، عرف العلماء أن كميته ضئيلة ضمن الخلايا الطبيعية، وأن معدل دورانه سريع. وفي 1992 اكتُشف Mdm2 الذي يكبح عمل البروتين بي 53، ثم تبين أنه بذاته هدف نسخي للبروتين بي 53، ما حدد حلقة التغذية الراجعة السلبية. كشفت الدراسات اللاحقة عن دور مهم مماثل لـ MdmX (وهو Mdm2 متشابه التركيب). وثبت أن Mdm2 عبارة عن ليغاز يوبيكويتين E3، ما يحفز تحلل البروتين بي 53. من المسلم به الآن أن عمل ubiquitinases و deubiquitinases يحددان نشاط شبكة البروتين بي 53.
تفسر هذه النتائج المستويات العالية نسبيًا من البروتين بي 53 في الأورام، وأن طفرات البروتين بي 53 خاملة نسخيًا ما يعطل حلقة التغذية الراجعة.
هل يعدل البروتين بي 53 كيميائيًا في الخلية؟
لا يكون البروتين بي 53 نشطًا داخل الخلايا ما لم يطرأ عليه تعديل لأول مرة بواسطة بروتينات أخرى. بعبارة أخرى، الكتلة الفعلية للبروتين بي 53 ليست بنفس أهمية كمية البروتين بي 53 المنشط، والبروتين بي 53 المنشط فقط يستطيع الارتباط بالحمض النووي وتحفيز التعبير عن جيناته المستهدفة.
عُرف منذ 1980 أن مستويات البروتين بي 53 تزداد بعد التشعيع، لكن في 1992 تبين أن ATM ينظم البروتين بي 53، وهو كيناز ينظم استجابة الحمض النووي للتلف. ثبت بعد ذلك أن البروتين بي 53 يُفسفر بعد تلف الحمض النووي، وكان أول بروتين غير هيستون ثبت أنه يؤستل بواسطة p300/CBP.
أظهرت الدراسات الكيميائية الحيوية أن تلف الحمض النووي المحرض بواسطة الكيناز مثل ATM و Chk2 يستطيع فسفرة ثمالات البروتين بي 53، وبدوره ينظم ارتباط البروتين بي 53 ب Mdm2 و p300/CBP. وتبين أيضًا أن بروتين ARF البديل -المعروف أنه ناتج عن عدد من الميتوجينات- يمنع قدرة Mdm2 على تحليل البروتين بي 53، ما يقلل بالنتيجة ربط البروتين بي 53 بالمسارات الورمية الرئيسية. وثبت أيضًا أن البروتين بي 53 يرتبط بعشرات البروتينات الأخرى ويشارك ضمن مجموعة واسعة من العمليات الفيزيولوجية.
ما مستقبل الأبحاث التي تتعلق بالبروتين بي 53؟
مع أنه توجد عشرات الآلاف من المنشورات المتعلقة بالبروتين بي 53، فتوجد الكثير من المعلومات التي تحتاج إلى إجراء المزيد من الأبحاث، مثل فهم الظروف البيئية الدقيقة التي تحفز اختيار الخلايا ذات النسخ الطافرة من البروتين بي 53، وهل التحفيز المستمر مفيد أم مضر بالحمض النووي؟ أو ربما أنواع الأكسجين النشطة مرتبطة بدورات متناوبة من نقص الأكسجة والنورموكسيا؟
بطريقة مماثلة، لا نفهم حتى الآن لماذا يؤدي التعبير عن البروتين بي 53 الوحشي إلى موت الخلايا المبرمج في بعض الخلايا وتوقف دورة الخلية في خلايا أخرى.
وربما الأهم من ذلك، أننا لا نعرف حتى الآن إمكانية استخدام المعارف الهائلة المكتسبة حول البروتين بي 53 وأغراضه العلاجية.
طورت مناهج ذكية واعدة، تهدف إلى منع المركبات ذات الوزن الجزيئي المنخفض أو الببتيدات التي ترتبط بطفرات البروتين بي 53 من التفاعل بين MDM2 وبروتين بي 53 الوحشي أو الفيروسات التي تتكاثر فقط في الخلايا بدون شبكة بروتين بي 53 وظيفية، وما يزال المجال مفتوحًا لإجراء دراسات و أبحاث ويُظهر التاريخ أن أكثر الأفكار الجديدة والإبداعية غالبًا ما تأتي من الطلاب.
الخلاصة
كشفت الأبحاث حول البروتين بي 53 أن العديد من المبادئ وراء تكوين الأورام البشرية تشمل الاختلافات الحرجة بين الجين الورمي والجين المثبط للورم، والعلاقة بين التعرض البيئي والسرطان، والآليات التي تُحفز جينات السرطان وتشكيل الخلايا الجديدة أو تثبط موت الخلايا، إضافةً إلى الشبكات التي تتحكم في النسخ ووظيفة البروتينات الخلوية الرئيسية.
إن الجوانب العديدة لهذه الدراسات، تُظهر حقيقة أن تعطيل البروتين بي 53 ضروري لمنع تشكيل غالبية الأورام البشرية، وجعلت من البروتين بي 53 هدفًا للأبحاث الأساسية والتطبيقية المستقبلية.
اقرأ أيضًا:
البروتين بي 53: بنيته ووظيفته وآلية عمله
ترجمة: سارة دامر
تدقيق: محمد حسان عجك